
Информация предназначена только для специалистов в области здравоохранения
Автор:P.А.Беккер1, Ю.В.Быков2
Номера страниц в выпуске:42-51
Мемантин – это слабый неконкурентный антагонист магниевого сайта в открытой конфигурации N-метил-D-аспартат-рецепторов (NMDA-рецепторов) с быстрой кинетикой связывания и диссоциации с рецептора и зависимостью связывания от потенциала мембраны. Благодаря этим свойствам он проявляет уникальное нормализующее влияние на глутаматергическую нейротрансмиссию, в то же время не мешая осуществлению нормальных физиологических функций NMDA-рецепторов. Он официально утвержден только для лечения болезни Альцгеймера. Однако поскольку дисфункция глутаматергической системы задействована в патогенезе многих психических заболеваний, то делаются попытки применять его и при них. При этом для многих психических патологий показан положительный эффект от применения мемантина с разной степенью убедительности и доказательности (наибольшее количество данных накоплено при применении мемантина при обсессивно-компульсивных расстройствах и депрессиях). В настоящей статье подробно рассматривается имеющаяся доказательная база применения мемантина в психиатрической практике по неклассическим показаниям, приводятся сводная таблица и обобщающие рекомендации.
Ключевые слова: мемантин, глутамат, N-метил-D-аспартат-рецепторы, деменция, депрессивные расстройства, обсессивно-компульсивное расстройство.
yubykov@gmail.com
Для цитирования: Беккер P.А., Быков Ю.В. Мемантин: возможности и перспективы применения в психиатрии (обзор современных данных). Психиатрия и психофармакотерапия. 2016; 18 (4): 42–51.
Memantine: opportunities and horizons of its use in psychiatry (review up to date)
R.A.Bekker1, Yu.V.Bykov2
1David Ben-Gurion University of the Negev. 8410501, Israel, Beersheba;
2Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310
Memantine is a weak, uncompetitive, antagonist of the magnesium site in an open-channel configuration of the N-methyl-D-aspartate-receptors (NMDA-receptors). It has a fast dissociation and binding kinetics, relatively low affinity, and its receptor binding is both use-dependent and voltage-dependent. This gives memantine a unique ability to restore and normalize glutamatergic neurotransmission and protect neurons from NMDA-receptor-mediated excitotoxicity and death, while not disrupting normal physiological NMDA-receptor regulation. It can be seen as a kind of “artificial magnesium”, more effective than magnesium itself. Memantine is approved by Food and Drug Administration (FDA) and European Medicines Agency (EMEA) for the symptomatic treatment of Alzheimer disease. But, as glutamatergic dysfunction plays a role in the pathogenesis of many, if not all, psychiatric disorders, memantine was tried in many of them, and often with positive results, but with different level of evidence quality. The most compelling evidence for memantine’s use exists for obsessive-compulsive disorder and depression. In this article new options and horizons formemantine’s use in psychiatry and the existing evidence thoroughly discussed.
Key words: memantine, glutamate, N-methyl-D-aspartate-receptors, dementia, major depression, obsessive-compulsive disorder.
yubykov@gmail.com
For citation: Bekker R.A., Bykov Yu.V. Memantine: a review of its use in psychiatry. Psychiatry and Psychopharmacotherapy. 2016; 18 (4): 42–51
Введение: общие фармакологические свойства мемантина
Теоретической основой для синтеза мемантина, изначально позиционировавшегося в качестве антидементного препарата при болезни Альцгеймера (БА), послужило наблюдение о том, что БА сопровождается повышенным выделением глутамата из воспалительно активированных отложениями b-амилоида клеток нейроглии, повышенной активацией N-метил-D-аспартат-рецепторов (NMDA-рецепторов), отмиранием аксонов и дендритов и в итоге гибелью нейронов из-за NMDA-опосредованной эксайтотоксичности (S.Stahl и соавт., 2013) [82].
Известно, что сильная и «безусловная» блокада NMDA-рецепторов нарушает память и когнитивные функции (КФ), препятствует долговременной потенциации (механизму, лежащему в основе процессов памяти) и процессам нейропластичности и вызывает гибель нейронов от недостатка стимуляции (создавая повреждения мозга, известные как лезии Олни). Примером этого может служить воздействие кетамина или высоких доз декстрометорфана. Каким же образом возможно добиться того, чтобы снизить избыточную активацию NMDA-рецепторов, такую, например, какая имеет место при БА, но при этом не нарушить нормальные физиологические процессы активации NMDA-рецепторов, лежащие в основе процессов памяти, синаптической пластичности, регуляции активности нейроглии?
Оказывается, это возможно. Мемантин в отличие от кетамина или декстрометорфана является слабым (низкопотентным, Ki~1106 nM) и неконкурентным антагонистом (негативным аллостерическим модулятором) NMDA-рецепторов с быстрой кинетикой блокады и освобождения (диссоциации) с рецептора (I.Bresink и соавт., 1995) [7]. Мемантин связывается не с основным (глутаматным) или глициновым сайтом рецептора, а с его магниевым сайтом, т.е. с сайтом, на котором ионы магния в норме обеспечивают «физиологический покой» NMDA-рецептора, предотвращая его избыточную активацию. Кроме того, мемантин в отличие от кетамина или декстрометорфана связывается только с такой конфигурацией рецептора, в которой открыт (активирован) ионный канал, но не связывается с неактивным рецептором и тем самым предотвращает избыточную и постоянную активацию NMDA-рецепторов, не препятствуя «нормальной» периодической физиологической активации этих же рецепторов в случае, если рецептор активируется редко (это называется use-dependent blockade – блокада, зависимая от использования рецептора). А связывание мемантина с рецептором является вольтажзависимым (voltage-dependent), т.е. зависит от электрического потенциала мембраны: мемантин связывается прежде всего с рецепторами активированных, перевозбужденных клеток. Вся эта совокупность фармакологических свойств и предопределяет как клиническое отличие мемантина от кетамина и декстрометорфана, так и его уникальные антидементные и противовоспалительные свойства, ради которых он изначально и синтезировался (S.Stahl и соавт., 2013) [82].
Сильно упрощая, можно сказать, что мемантин для NMDA-рецепторов является синтетическим аналогом ионов магния (Mg2+), имеющим в отличие от ионов магния более удобный длительный период полувыведения, большее время удержания на рецепторе и более высокий аффинитет, что предопределяет более высокую клиническую эффективность мемантина в терапии дементных состояний по сравнению с применением высоких доз препаратов магния (попытки чего предпринимались задолго до синтеза мемантина с некоторым эффектом).
Важно отметить, что мемантин был синтезирован «не на пустом месте». Его синтез является результатом целенаправленной модификации молекулы амантадина, которая была предпринята после того, как стало известно, что амантадин, препарат, изначально применявшийся при болезни Паркинсона (БП), частично обязан своим антипаркинсоническим действием не только способности влиять на выделение и обратный захват дофамина и своим трициклик-подобным антихолинергическим (М-холинолитическим) свойствам, но и способности связываться с магниевым сайтом NMDA-рецептора с указанной кинетикой (слабый аффинитет, быстрое связывание и освобождение рецептора), а также что амантадин положительно воздействует на КФ пациентов не только с БП, но и БА, депрессиями, шизофренией. Мемантин был синтезирован как препарат, обладающий более высокой по сравнению с амантадином специфичностью и избирательностью к NMDA-рецептору, более высоким аффинитетом, практически лишенный антихолинергических свойств амантадина, вредных в контексте лечения деменций (но не полностью лишенный дофаминопозитивных свойств, что в этом контексте, наоборот, важно и полезно; S.Stahl и соавт., 2013) [82].
Способность мемантина связываться с магниевым сайтом NMDA-рецептора является не единственным фармакологическим свойством, обусловливающим его прокогнитивные свойства. Мемантин связывается также с так называемыми d2-рецепторами (Ki~1000 nM), которые имеют сходство с NMDA-глутаматными рецепторами, но не активируются глутаматом; их физиологическая роль и эндогенные лиганды еще окончательно не выяснены, предположительно их лигандами могут быть эндорфины (K.Williams и соавт., 2003) [89]. Кроме того, мемантин связывается с имидазолиновыми I1 и I2-рецепторами (Ki~669 nM для I1-рецептора), подобно клонидину, моксонидину; это может обусловливать как наличие у него анальгетических свойств, так и положительное влияние на КФ и церебральную гемодинамику (сосудорасширяющее действие), повышение инсулиночувствительности тканей, снижение аппетита, противовоспалительные свойства и др. (S.Jiang и соавт., 2010) [32].
Мемантин также является антагонистом s1 (Ki 4131 nM) и s2-рецепторов (Ki 9450 nM; M.Peeters и соавт., 2004; T.Maurice, 2016) [46, 59]. Это также может дополнять не только прокогнитивные и антидементные, но и антидепрессивные и анксиолитические свойства мемантина. Помимо этого мемантин является слабым антагонистом 5-HT3-рецепторов (Ki~530 nM; G.Rammes и соавт., 2001) [64], что может дополнительно усиливать его прокогнитивное, антидементное, антидепрессивное и анксиолитическое действие, так как 5-HT3-блокада косвенным образом приводит к повышению уровней моноаминов и ацетилхолина в префронтальной коре (S.Stahl и соавт., 2013) [82]. В этой связи интересно отметить, что вклад 5-HT3-антагонизма в общую эффективность мемантина при деменциях, по-видимому, не так уж мал, и это подтверждается, в частности, тем, что противорвотное средство трописетрон, являющееся сильным антагонистом 5-HT3-рецепторов, улучшает КФ в экспериментальной модели БА у мышей, а также тормозит накопление белка-прекурсора амилоида и с 2014 г. испытывается при БА у людей (P.Spilman и соавт., 2014) [81]. И наоборот, мемантин, как оказалось, обладает клинически значимой противорвотной активностью, подтверждающейся также и в экспериментах на животных (при рвоте, индуцированной цисплатином, что служит экспериментальной моделью рвоты при высокоэметогенной химиотерапии; A.Lehmann, L.Kärrberg, 1996) [43].
Кроме того, показано, что мемантин помимо своего взаимодействия с NMDA и 5-HT3-серотониновыми рецепторами взаимодействует также и с некоторыми другими ионотропными рецепторами, в частности никотиновыми холинорецепторами, что также может вносить свой вклад в его прокогнитивную и антидементную активность (M.Rogawski, 2004) [67].
Мемантин восстанавливает патологически сниженную активность эндотелиальной синтазы оксида азота (eNOS) и благодаря этому оказывает вазодилатирующее, ангиопротективное и антиишемическое действие, например, в моделях церебрального ангиоспазма после субарахноидального кровоизлияния или в модели сосудистой эректильной дисфункции (C.Huang и соавт., 2015) [29]. Интересно при этом отметить, что нейрональную синтазу оксида азота (nNOS), гиперактивность которой является одной из причин воспаления и свободнорадикального повреждения клеток и повышенного нитрозилирования белков, мемантин, наоборот, угнетает, что частично обусловливает его противовоспалительные, антиоксидантные и нейропротекторные свойства и способность защищать нейроны от преждевременного старения и оксидативного стресса (H.Ota и соавт., 2015) [57].
Мемантин не связывается с опиоидными, a1 или a2-адренорецепторами, мускариновыми холинорецепторами, ГАМК-рецепторами или с большинством подтипов серотониновых рецепторов, однако способен связываться, хотя и с довольно низким, но, по-видимому, клинически значимым (сопоставимым с буспироном) аффинитетом с 5-HT1A-рецепторами, что может объяснять его антидепрессивные и анксиолитические свойства (N.Osborne и соавт., 1982) [56].
Болезнь Альцгеймера и другие деменции
В недавнем суммирующем метаанализе нескольких Кохрановских систематических метаанализов показана эффективность мемантина при БА как в монотерапии, так и в комбинации с ингибиторами холинэстеразы (K.Laver и соавт., 2016) [40]. В рандомизированном контролируемом исследовании (РКИ) показано, что мемантин действенен не только при уже установленной БА, но и в ее начальных стадиях, часто расцениваемых как легкое возрастное когнитивное ухудшение (p<0,01; A.Ströhle и соавт., 2015) [84].
В другом РКИ показано, что мемантин также эффективен при фронтотемпоральной деменции (p<0,05; T.Kishi и соавт., 2015) [34]. Еще одно РКИ сравнивало эффективность мемантина с плацебо в профилактике и лечении лучевой деменции при облучении центральной нервной системы (ЦНС) у пациентов с опухолями мозга или метастазами в мозг, при этом были получены статистически достоверные (p<0,05) данные об его эффективности (J.Day и соавт., 2014) [17]. Подтверждена в РКИ результативность мемантина также при сосудистой или постинсультной деменции (p<0,001; E.Mori, 2016) [49]. Имеются исследования мемантина при некоторых других деменциях, например деменции телец Леви (C.Stinton и соавт., 2015) [83] или ВИЧ-ассоциированной деменции, не достигшие положительного результата. Одновременно имеются описания случаев или открытые исследования о его возможной эффективности при этих состояниях (Y.Zhao и соавт., 2010) [90].
Важно отметить, что в случае БА применение мемантина является официально утвержденным Food and Drug Administration (FDA – Управление по контролю пищевых продуктов и лекарств в США), European Medicines Agency (EMEA – Европейское агентство по лекарственным средствам) и Минздравом России показанием.
Шизофрения
Шизофрения сопровождается гиперактивацией кинуренинового пути метаболизма триптофана, что приводит к нарушениям в работе глутаматергической системы (M.Koola, 2016) [35]. А галантамин, являющийся, кроме своих свойств ингибитора ацетилхолинэстеразы, также позитивным аллостерическим модулятором a7-подтипа никотиновых холинорецепторов, и мемантин, являющийся антагонистом NMDA-рецепторов, способны контрбалансировать негативное влияние избытка кинурениновой кислоты на деятельность ЦНС и, в частности, вызываемые ею когнитивные нарушения при шизофрении (M.Koola, 2016) [90]. При этом положительное действие галантамина и мемантина на КФ больных шизофренией взаимно усиливается при их сочетании, а также зависит от фармакогенетических особенностей пациента, в частности от того, какими конкретно аллелями генов a7-никотинового рецептора (CHRNA7), NMDA-рецептора подтипа 1 (GRM1), гена белка, связывающего дистробревин (DTNBP1), и гена фермента, метаболизирующего кинурениновую кислоту, кинуренин-3-монооксигеназы обладает данный конкретный больной (M.Koola, 2016) [90].
Еще одним теоретическим обоснованием попыток применения мемантина при шизофрении является тот факт, что в патогенезе шизофрении так же, как и в патогенезе депрессивных состояний, биполярного аффективного расстройства (БАР) и таких нейродегенеративных заболеваний, как БА, БП, играет большую роль воспалительная гиперактивация нейроглии (H.Hong, 2016) [28]. А ведь известно, что мемантин обладает сильной противовоспалительной активностью, угнетает воспалительную активацию нейроглии и бывает эффективен в уменьшении явлений воспаления ЦНС не только при БА, но и таких состояниях, как острое отравление угарным газом или ишемический инсульт, а также усиливает противовоспалительное действие глюкокортикоидов при этих состояниях (K.Iwamoto и соавт., 2014) [31]. Это дало основание предположить, что противовоспалительное действие мемантина может проявляться и при шизофрении.
Все эти данные послужили основанием для того, чтобы попытаться применить мемантин в качестве аугментатора к клозапину при резистентной шизофрении в двойном слепом рандомизированном плацебо-контролируемом испытании, в котором участвовали по 26 пациентов в каждой группе (S.Veerman и соавт., 2016) [86]. Теоретической основой для сочетания мемантина именно с клозапином, а не с другими антипсихотиками, послужило то, что клозапин, как известно, среди прочих своих фармакологических свойств обладает свойствами парциального агониста (агониста-антагониста) NMDA-рецепторов (S.Veerman и соавт., 2016) [86]. При этом были получены достоверные положительные результаты в отношении улучшения вербальной и визуальной памяти, настроения, уровня тревожности, КФ, негативной симптоматики, а также одного из субдоменов продуктивной симптоматики (критическое отношение к психопродукции) у этой категории пациентов, снижение показателей негативной подшкалы PANSS в среднем на 30% (p<0,01; S.Veerman и соавт., 2016) [86]. В другом РКИ было показано, что добавление мемантина к антипсихотикам достоверно улучшает общее качество жизни пациентов и повышает общий уровень их функционирования, в том числе социального и когнитивного (p<0,001; V.Omranifard и соавт., 2015) [55]. Ряд метаанализов, обобщающих данные РКИ, также отмечает положительный эффект добавления мемантина к терапии антипсихотиками в отношении депрессивной, когнитивной и негативной симптоматики шизофрении (Y.Matsuda и соавт., 2013; S.Shim, R.Nadeem, 2014) [45, 75]. Интересно также отметить сообщение случая, описывающее пациента, у которого мемантин способствовал похудению и воспрепятствовал дальнейшему набору массы тела на клозапине наряду с уменьшением негативной и когнитивной симптоматики (M.Schaefer и соавт., 2007) [69]. Авторы этой статьи призывают изучить мемантин также в качестве возможного средства профилактики вызванного антипсихотиками набора массы тела и ожирения.
В одном российском РКИ, однако, был получен отрицательный результат – группа мемантина статистически не отличалась от группы плацебо в качестве дополнительного средства при лечении негативной симптоматики при параноидной шизофрении (Ю.Ю.Осадший и соавт., 2015) [2]. Однако в этом исследовании больные получали в качестве антипсихотика не клозапин.
Злокачественный нейролептический синдром
Злокачественный нейролептический синдром (ЗНС) – это редкое, но потенциально фатальное осложнение терапии мощными антипсихотиками, имеющее большое клиническое и патогенетическое сходство с фебрильной кататонией. Ключевыми симптомами ЗНС являются гипертермия, мышечная ригидность, выраженная вегетативная нестабильность, тяжелые экстрапирамидные расстройства (ЭПР). При ЗНС эффективны прямые и непрямые агонисты дофаминовых рецепторов (бромокриптин, прамипексол, амантадин и др.), а также дантролен (J.Kornhuber и соавт., 1993) [36]. Поскольку мемантин благодаря своему NMDA-антагонизму косвенно является продофаминергическим агентом и способен уменьшать ЭПР, вызываемые антипсихотиками, а при ЗНС наблюдается гиперактивация глутаматергической системы и других систем возбуждающих аминокислот, то это дало основание попытаться применять его и при ЗНС (M.Weller, J.Kornhuber, 1992; J.Kornhuber и соавт., 1993) [36, 87]. При этом были получены положительные результаты, а эффективность мемантина оказалась сопоставима с таковой у амантадина и бромокриптина (M.Weller, J.Kornhuber, 1992; J.Kornhuber и соавт., 1993) [36, 87]. Сочетание мемантина с бромокриптином или амантадином дополнительно улучшало терапевтический эффект при ЗНС (J.Kornhuber и соавт., 1993) [36].
Аутизм и расстройства аутистического спектра
В одном открытом проспективном исследовании показано, что мемантин эффективен в устранении нарушений социального взаимодействия у интеллектуально сохранных взрослых с расстройствами аутистического спектра, включая высокофункциональный аутизм и синдром Аспергера (G.Joshi и соавт., 2016) [33]. Кроме улучшений социального взаимодействия и уменьшения симптоматики аутизма, совершенствовались также и когнитивные способности и память этих пациентов, а также проявления нередких коморбидных с аутизмом психопатологий депрессивного и тревожного круга и синдрома дефицита внимания (СДВ) или СДВ с гиперактивностью – СДВГ (G.Joshi и соавт., 2016) [33].
Учитывая, что мемантин эффективен при обсессивно-компульсивном расстройстве (ОКР) и ОКР-подобных состояниях, а аутизм часто сопровождается навязчивыми персеверациями тех или иных действий, слов, выражений, в настоящее время проводится большое РКИ по изучению эффективности мемантина у детей с коморбидностью аутизма или расстройств аутистического спектра, и расстройств ОКР-спектра; результаты ожидаются к 2018 г. (A.Häge и соавт., 2016) [26].
В одном РКИ изучали действенность мемантина в коррекции поведенческих нарушений, в частности импульсивности и агрессивности, у детей с аутизмом и расстройствами аутистического спектра, получающих рисперидон. Было показано, что добавление мемантина к рисперидону приводит к значимому улучшению поведения больных аутизмом детей, уменьшению их импульсивности и агрессивности, а также гиперактивности, персеверационного и стереотипного поведения по сравнению с плацебо (p<0,001; A.Ghaleiha и соавт., 2013) [22]. При этом мемантин хорошо переносился детьми и давал мало побочных эффектов (p<0,001; A.Ghaleiha и соавт., 2013) [23].
В другом небольшом открытом исследовании, куда вошли 14 детей в возрасте 3–12 лет с расстройствами аутистического спектра, мемантин, назначаемый в дозе 5–20 мг/сут, привел к улучшению (коррекции) поведенческих симптомов: гиперактивности, вялости и раздражительности, а также улучшению памяти (T.Owley и соавт., 2006) [58]. В еще одном открытом 19-недельном исследовании, в которое были включены 18 пациентов с этой же патологией в возрастном диапазоне 6–19 лет, мемантин назначался в дозе 20 мг/сут (C.Erickson и соавт., 2007) [19]. Авторами этого исследования было отмечено положительное влияние мемантина на социальное отчуждение и невнимательность, с умеренным положительным влиянием на раздражительность.
В более объемном открытом исследовании (M.Chez и соавт., 2007) [14], куда вошли и дети (от 2,5 года), и молодые взрослые (до 26 лет) с расстройствами аутистического спектра, улучшение в плане социальных навыков было отмечено у 71% пациентов при назначении мемантина в дозировке 2,5–30 мг/сут.
Один из исследователей аутизма называет мемантин наряду с такими интенсивно изучаемыми сегодня агентами, как окситоцин, инсулиноподобный фактор роста-1, арбаклофен, одним из наиболее многообещающих агентов для терапии «ядерных» симптомов аутизма, а именно нарушений социального взаимодействия (R.Canitano, 2014) [9].
В опубликованном в 2014 г. систематическом метаобзоре применения «антидементных» лекарств при аутизме указывается, что доказательная база, имеющаяся на сегодняшний день у мемантина (9 исследований, из которых одно крупное РКИ 8 из 9 исследований, включая РКИ, показали положительные результаты) и галантамина (4 исследования, из которых 2 РКИ, все показали положительные результаты), позволяет уверенно рекомендовать оба этих препарата для лечения как «ядерных», так и ассоциированных с аутизмом симптомов, в то время как доказательная база для применения при аутизме донепезила и ривастигмина выглядит гораздо скромнее (D.Rossignol, R.Frye, 2014) [68].
Эффективность мемантина подтверждается и в экспериментальной модели аутизма на животных (пренатальное воздействие вальпроевой кислоты), при этом мемантин не только улучшает аномальное поведение экспериментальных животных, но и корректирует отклонения в биохимии и нейрофизиологии мозга, вызванные пренатальным воздействием вальпроатов, восстанавливает целостность гематоэнцефалического барьера, уменьшает воспалительную активацию нейроглии, оксидативный и нитрозативный стресс (H.Kumar, B.Sharma, 2016) [38].
Кататонические состояния разного генеза
При данных патологических состояниях эффективность мемантина описана только в серии клинических случаев. Серьезных РКИ, а также открытых пилотных исследований при этой патологии нет. Рассмотрим отдельные работы в виде описаний случаев.
Так, например, описан 58-летний мужчина, у которого после пересадки печени в послеоперационном периоде были зафиксированы бред и симптомы кататонии. Назначенные рисперидон, сертралин и миртазапин оказались неэффективны. Назначенный после этого мемантин купировал и бредовые нарушения, и кататонию (G.Brown и соавт., 2016) [8].
Другими авторами описывается 32-летний мужчина, у которого были диагностированы проявления кататонии на фоне каннабиноидного абстинентного синдрома (M.Caudron и соавт., 2016) [13]. Комбинированная терапия лоразепамом и мемантином в данном случае привела к купированию симптомов кататонии.
Еще один клинический случай описывает 92-летнюю женщину с тяжелой депрессией, осложнившейся развитием кататонии (D.Obregon и соавт., 2011) [53]. Назначение мемантина у этой пациентки привело к устранению симптомов кататонии.
В другом сообщении (S.Carpenter и соавт., 2006) [10] описывается случай 68-летнего мужчины, у которого назначение мемантина в дозе 10 мг/сут привело к быстрому купированию кататонии, развившейся в рамках кататонической формы шизофрении. Авторы этого сообщения предполагают, что положительный эффект в данном случае обусловлен глутаматергической дисфункцией, которая играет роль и в патогенезе шизофрении вообще, и в патогенезе кататонических состояний вообще, но особенно заметную роль играет в патогенезе кататонической шизофрении.
Синдром дефицита внимания
Глутаматергическая дисфункция при СДВ и СДВГ была обнаружена около 15 лет назад (N.Carrey и соавт., 2002) [11]. Мемантин, являясь NMDA-антагонистом, обладает способностью косвенно повышать уровень дофамина в префронтальной коре и устранять дефицит дофаминергической нейротрансмиссии, лежащий в основе патогенеза СДВ и СДВГ. Это дало основание попытаться его применять при данных состояниях. В одном РКИ, включавшем 40 пациентов (34 мальчика и 6 девочек в возрасте от 6 до 11 лет) с СДВ и СДВГ, сравнивали мемантин со стандартным для этих состояний лечением психостимулятором метилфенидатом, при этом было показано, что эффективность мемантина несколько ниже, чем метилфенидата, но достоверно отличается от плацебо, и что мемантин лучше переносится в этой возрастной группе пациентов и имеет мало побочных эффектов (p<0,01; M.Mohammadi и соавт., 2015) [48].
В еще одном небольшом (12 пациентов в группе мемантина и 14 – в группе плацебо) пилотном РКИ изучали эффективность добавления мемантина к стандартной терапии психостимулятором при СДВ/СДВГ взрослых, причем исследователей особенно интересовала так называемая исполнительная дисфункция (проявляющаяся, в частности, неорганизованностью, неумением планировать свое время, добиваться реализации намеченных планов), плохо поддающаяся стандартной терапии психистимуляторами (J.Biederman и соавт., 2014) [5]. При этом было показано, что добавление мемантина к стандартной терапии психостимуляторами приводит к клиническому улучшению как по части основной симптоматики СДВ/СДВГ (например, нарушений концентрации внимания, повышенной отвлекаемости), так и по части некоторых поддоменов исполнительных функций и как следствие – лучшей адаптации пациентов с СДВ/СДВГ в обществе и на рабочем месте (J.Biederman и соавт., 2014) [5]. В силу малого размера выборки критерий Стьюдента авторами исследования не рассчитывался. Авторы этого исследования делают вывод, что мемантин заслуживает дальнейшего изучения как одно из дополнительных средств терапии при СДВ/СДВГ взрослых. Помимо упомянутых двух РКИ на возможную эффективность мемантина при СДВ/СДВГ указывают также ряд открытых проспективных исследований и описаний случаев.
Депрессивные состояния
При лечении мемантином установлен регресс депрессивных расстройств у пациентов с ишемическим инсультом по сравнению с пирацетамом (С.В.Котов и соавт., 2005) [1]. В открытое исследование вошли 38 больных, перенесших ишемический инсульт: 23 мужчины (60,5%) и 15 женщин (39,5%). Авторы данного исследования связали это с улучшением межнейронной передачи информации в головном мозге.
В одном РКИ, посвященном изучению эффективности мемантина при гериатрической депрессии у пациентов старше 60 лет, реактивно возникающей после неблагоприятных медицинских событий (таких как инфаркт, обнаружение рака и т.д.), было показано, что мемантин в дозе 20 мг/сут (начальная доза 10 мг/сут) статистически достоверно превосходит плацебо при лечении этой патологии (p<0,005). В обеих группах (мемантина и плацебо) участвовали по 35 больных (E.Lenze и соавт., 2012) [44].
В двойном слепом РКИ показана действенность мемантина при лечении депрессивных нарушений у пациентов с алкогольной зависимостью (p<0,001; L.Muhonen и соавт., 2008) [50]. В данном исследовании антидепрессивный эффект мемантина, который назначался в дозе 20 мг/сут, был сопоставим с эффектом эсциталопрама в дозе 20 мг/сут, который был назначен в параллельной группе.
В открытом пилотном исследовании у 8 пациентов с резистентным большим депрессивным расстройством показана эффективность мемантина при титровании дозы препарата в сторону увеличения (J.Ferguson, R.Shingleton, 2007) [20]. Так, пациенты в течение 4 нед получали 20 мг мемантина в сутки, до 8-й недели – 30 мг/сут, до 10-й недели – 40 мг/сут, что привело к купированию депрессивной симптоматики.
Важно также отметить, что антидепрессивные свойства мемантина проявляются не только при терапии собственно депрессивных расстройств, но и в разных других клинических ситуациях, например, при лечении шизофрении, БА и т.д. терапия мемантином часто приводит к улучшению коморбидной депрессивной симптоматики, о чем идет речь в соответствующих разделах нашей статьи.
Биполярное аффективное расстройство
Описано значительное количество случаев, в которых применение мемантина при БАР оказывалось эффективным в плане не только лечения биполярной депрессии, но и долгосрочной стабилизации настроения. Так, в частности, описаны 3 успешных случая, в которых применение мемантина после вынужденной отмены лития после его многолетнего приема из-за осложнений (со стороны почек или щитовидной железы) или по желанию пациента позволило поддерживать эутимию (G.Serra и соавт., 2014) [72]. В другом интересном случае мемантин оказался эффективен и в острой фазе (как антиманиакальное средство), и как средство длительной поддерживающей терапии при БАР типа 2 у пациентки, до того безуспешно получавшей разнообразную психофармакотерапию, при этом мемантин также попутно уменьшил проявления коморбидной фибромиалгии (G.Serra и соавт., 2014) [73].
Описаны также два случая, в которых мемантин оказался эффективен в качестве антиманиакального средства и стабилизатора настроения при БАР типа 1 у пациентов, почти не получавших до этого психофармакотерапию (G.Serra и соавт., 2013) [71]. А в 12-месячном открытом натуралистическом исследовании эффективности мемантина в качестве аугментатора при полирезистентном БАР (смешанная когорта больных с 1 и 2-м типом течения, а также с «другим и неуточненным» биполярным расстройством) мемантин оказался эффективен в плане долгосрочной стабилизации настроения и профилактики рецидивов аффективных фаз, несмотря на высокую исходную степень резистентности этих пациентов (A.Koukopoulos и соавт., 2012) [37]. В более длительном, трехлетнем открытом натуралистическом исследовании эффективности мемантина как адъюванта к стандартной психофармакотерапии при терапевтически резистентном БАР эти результаты также подтвердились (G.Serra и соавт., 2015) [74].
В одном довольно большом (n=106 в группе мемантина; n=108 в группе контроля) РКИ было показано, что добавление мемантина к стандартной психофармакотерапии при биполярной депрессии снижает как клинические проявления депрессивного синдрома, так и уровни воспалительных цитокинов в крови, в особенности основного и наиболее часто повышающегося при них – фактора некроза опухоли a (p<0,001; S.Lee и соавт., 2014) [42]. Также показано, что мемантин положительно влияет на липидный профиль, уровни холестерола и глюкозы, снижает аппетит и вероятность развития метаболического синдрома при БАР (p<0,001; S.Lee и соавт., 2013) [41].
Описан также случай, когда лечение литием, оланзапином и антидепрессантами оказалось неэффективным при биполярной депрессии, в то время как добавление мемантина с постепенной титрацией дозы до 20 мг/сут привело к ремиссии, в том числе улучшению когнитивной симптоматики, дневной активности, настроения больного (D.Strzelecki и соавт., 2013) [85]. В другом случае добавление мемантина к терапии у пациентки с коморбидным БАР и тяжелым расстройством пищевого поведения привело к значительному улучшению как симптоматики БАР, так и расстройства пищевого поведения (L.De Chiara и соавт., 2014) [18].
Тревожные состояния
Глутамат, как полагают, играет важную роль в патофизиологии тревожных расстройств (ТР). Повышенное количество этого нейротрансмиттера лежит в основе патогенеза тревоги (B.Cortese, K.Phan, 2005) [15]. Мемантин, который использовали в качестве аугментации у больных с разными ТР (паническое расстройство, социофобия, генерализованное ТР – ГТР с неполным ответом на терапию селективными ингибиторами обратного захвата серотонина – СИОЗС), вводили в дозе 5–20 мг/сут (в среднем
14 мг/сут). При этом было показано, что мемантин эффективно снижает проявления тревоги у большинства из этих 15 пациентов по сравнению с контрольной группой, получавшей плацебо, а 40% из этих больных достигли ремиссии (уменьшения показателя HAM-A ниже 7 баллов; p<0,05; T.Schwartz и соавт., 2012) [70].
Есть сообщения об эффективности мемантина при разных ТР в педиатрической практике (A.Rapp и соавт., 2013) [65]. Мемантин улучшает память и КФ у пациентов с ТР параллельно с редукцией самой тревоги (H.Nandhra и соавт., 2013) [51]. Анксиолитический эффект мемантина показан также и в экспериментах на животных (R.Minkeviciene и соавт., 2008) [47].
В одном открытом исследовании показано, что мемантин эффективен как при ОКР, так и ГТР, при этом результативность мемантина при ОКР была выше, но и при ГТР была значительной (J.Feusner и соавт., 2009) [21].
Анксиолитический и антидепрессивный эффект мемантина (устранение коморбидной тревожной и депрессивной симптоматики) также неоднократно показан в разных других клинических ситуациях: при лечении фибромиалгии (B.Olivan-Blázquez и соавт., 2014) [54], шизофрении (S.Veerman и соавт., 2016) [86], мигрени (R.Noruzzadeh и соавт., 2016) [52], при профилактике и лечении постмастэктомической нейропатической боли (G.Pickering и соавт., 2014) [61], при аугментации антидепрессантов в рамках лечения депрессии (E.Smith и соавт., 2013) [78], при аутизме (G.Joshi и соавт., 2016) [33], при терапии БА и возрастной когнитивной дисфункции (I.Ishikawa и соавт., 2016) [30], при лечении БП (E.Lauterbach, 2016) [39], нарушений пищевого поведения (B.Brennan и соавт., 2008) [6] и др.
В одном открытом исследовании, включавшем 26 ветеранов с посттравматическим стрессовым расстройством (ПТСР) после военной службы, мемантин наряду с улучшением когнитивной симптоматики улучшал и показатели тревожности и депрессии, и «ядерную» симптоматику ПТСР (например, уменьшал частоту навязчивых воспоминаний о психотравмирующей ситуации и частоту кошмарных сновидений) при лечении ПТСР (S.Ramaswamy и соавт., 2015) [63].
ОКР и ОКР-подобные состояния
В недавнем открытом исследовании мемантин оказался результативным при лечении ОКР в качестве поддерживающей терапии после внутривенных инъекций другого антагониста NMDA-рецепторов – кетамина. Мемантин в дозе 5–10 мг/сут, который получали 15 пациентов с ОКР, дал положительный результат (C.Rodriguez и соавт., 2016) [66].
В еще одном открытом исследовании показано, что мемантин, назначенный в дозе 10 мг/сут в течение 2 нед, уменьшал компульсивную тягу при игровой зависимости у 28 пациентов мужского пола (J.Grant и соавт., 2010) [24]. Этими же авторами в другом открытом исследовании показана эффективность мемантина у 12 больных с клептоманией, которые получали препарат в течение 8 нед в дозе 10–30 мг/сут (J.Grant и соавт., 2013) [25].
Имеются также РКИ, подтверждающие эффективность мемантина в качестве аугментатора (потенцирующего агента) при ОКР. Так, например, в одном РКИ исследовали эффективность добавления мемантина к стандартной терапии ОКР при среднем и тяжелом течении заболевания; у 89% из 34 пациентов был получен положительный результат, выразившийся в уменьшении частоты и выраженности обсессий и компульсий, снижении уровня коморбидной тревоги и депрессии, нормализации показателей шкалы YBOCS до значений, соответствующих ремиссии, при этом в группе контроля частота аналогичного улучшения составила лишь 32% (p<0,001; A.Ghaleiha и соавт., 2013) [22]. А в одном открытом исследовании была показана результативность аугментации мемантином при терапевтически резистентном ОКР, причем, что важно подчеркнуть, у всех участвовавших в исследовании больных давность заболевания превышала 5 лет, все они ранее пробовали разные антидепрессанты, аугментационные стратегии «первой линии» (добавление антипсихотиков, сочетание кломипрамина с СИОЗС и др.), а трое из участвовавших в исследовании 12 пациентов даже получали электросудорожную терапию без особого эффекта; тем не менее более чем 25% редукция по шкале YBOCS при применении мемантина (20 мг/сут в течение 12 нед) была достигнута у всех 12 больных (A.Bakhla и соавт., 2013) [4]. А в двух свежих обзорах, посвященных рассмотрению разных аугментационных стратегий при резистентном ОКР, неудачах аугментационной терапии 1-й линии, говорится о том, что эффективность мемантина в качестве аугментатора при ОКР наравне с действенностью таких аугментирующих агентов, как, например, ондансетрон или миртазапин, является точкой экспертного консенсуса (S.Arumugham, J.Reddy, 2013; D.Castle, 2015) [3, 12].
Интересен также описанный в литературе случай значительного клинического улучшения при добавлении мемантина к стандартной терапии ОКР у подростка с ОКР на фоне синдрома Дауна. Как знают клиницисты, ОКР на фоне синдрома Дауна часто бывает особенно резистентным к терапии, в основе чего, как предполагается, лежит нарушение глутаматергической и «сероводородной» (H2S) нейротрансмиссии при этом синдроме, обусловленное гиперэкспрессией некоторых генов, расположенных на «лишней» хромосоме 21 (S.Pekrul, K.Fitzge-rald, 2015) [60].
Синдром деперсонализации-дереализации
Хорошо известно, что синдром деперсонализации-дереализации (ДП/ДР) сопровождается выраженной дисфункцией глутаматергической системы мозга, в частности системы NMDA-рецепторов (A.Pikwer, 2011) [62]. Известно также, что мощные конкурентные NMDA-антагонисты, такие как кетамин, фенциклидин, способны вызывать синдром ДП/ДР (в том числе и такой, который закрепляется у больного и после окончания действия препарата) и служат надежной экспериментальной моделью синдрома ДП/ДР на здоровых добровольцах (L.Wilkins и соавт., 2012) [82]. С другой стороны, также известно, что ламотриджин, снижающий гиперактивацию глутаматергической системы, уменьшает или предотвращает симптомы ДП/ДР, вызванные кетамином в эксперименте, а в сочетании с препаратами группы СИОЗС, селективными ингибиторами обратного захвата серотонина и норадреналина или кломипрамином эффективен и при лечении синдрома ДП/ДР различного генеза в клинической практике (M.Sierra, 2012; E.Somer и соавт., 2013) [76, 80].
Однако часть пациентов с синдромом ДП/ДР оказываются резистентными к терапии ламотриджином в комбинации с серотонинергическим антидепрессантом, считающейся ныне терапией 1-й линии при этой патологии. Показано, что ионы магния, являющиеся физиологическими антагонистами NMDA-рецепторов и снижающие их гиперактивацию, в то же время не препятствуя их нормальной активации, в отличие от кетамина и фенциклидина (сильных конкурентных антагонистов NMDA-рецепторов), наоборот, снижают симптоматику синдрома ДП/ДР, т.е. обладают антидеперсонализационным действием (D.Simeon, J.Abugel, 2008; M.Sierra, 2012) [76, 77]. Однако широкое применение высоких доз препаратов магния в лечении синдрома ДП/ДР сдерживается плохой их пероральной всасываемостью, слабительным эффектом больших доз магния перорально и неудобствами их парентерального применения, а также такими побочными эффектами, как гипотензия, приливы жара и др. Мемантин, также являющийся близким к физиологическому (use-dependent) антагонистом NMDA-рецепторов и связывающийся с магниевым сайтом NMDA-рецептора, но активный при пероральном применении и имеющий более удобный по сравнению с магнием большой период полувыведения, также обладает выраженным антидеперсонализационным действием у больных, резистентных к комбинации ламотриджина с СИОЗС, и усиливает антидеперсонализационное действие этой комбинации в нерезистентных случаях. При этом помимо уменьшения симптоматики собственно синдрома ДП/ДР у больных, получивших аугментацию мемантином, также улучшались память и показатели когнитивного функционирования (на что пациенты с этим синдромом жалуются очень часто), уменьшались ощущение «пустоты в голове», а также симптомы коморбидной депрессии и тревоги (D.Simeon, J.Abugel, 2008; M.Sierra, 2012) [76, 77].
Расстройства пищевого поведения
Мемантин уменьшает выраженность компульсивного переедания в нескольких экспериментальных моделях на животных (K.Smith и соавт., 2015) [79]. При этом он особенно избирательно подавляет в эксперименте влечение к высококалорийной пище (которой, как известно, такие больные злоупотребляют; P.Popik и соавт., 2011). Кроме того, давно известно, что мемантин способствует нормализации нарушенного пищевого поведения и аппетита у пациентов с БА как в монотерапии, так и в комбинации с ингибиторами холинэстеразы (J.Cummings и соавт., 2006) [16]. Описан случай, когда лечение мемантином больной с БАР типа 2 и коморбидной булимией привело к нормализации как аффективного статуса, так и пищевого поведения (L.De Chiara и соавт., 2014) [18]. Применение мемантина в качестве адъюванта к вальпроатам при БАР привело к нормализации аппетита, липидного профиля, снижению уровня общего холестерола и липопротеидов низкой плотности и повышению липопротеидов высокой плотности и уменьшению массы тела больных по сравнению с плацебо (S.Lee и соавт., 2013) [41].
Данные о действенности мемантина в моделях компульсивного переедания на животных послужили основанием для проведения пилотного открытого проспективного исследования мемантина в качестве препарата для лечения компульсивного переедания (P.Brennan и соавт., 2008) [6]. В этом исследовании участвовали 16 пациентов, из которых 9 завершили исследование. У всех больных, которые завершили исследование, отмечались улучшение пищевого поведения, выразившееся в уменьшении количества дней, когда у пациентов случались эпизоды переедания, урежение эпизодов «припрятывания пищи на будущее», уменьшение выраженности компульсивного влечения к пище, дисфории, наступавшей в случае невозможности реализации влечения, уменьшение количества съеденной пищи, а также улучшение социального функционирования и отношений с домашними (B.Brennan и соавт., 2008) [6]. Авторы исследования отметили также уменьшение симптомов коморбидной депрессии и тревоги. Эффект в отношении редукции избыточной массы тела, однако, был умеренным, а в некоторых случаях вовсе отсутствовал (B.Brennan и соавт., 2008) [6]. Тем не менее авторы считают мемантин заслуживающим дальнейшего исследования в формате РКИ при компульсивном переедании. Мемантин также предложен для лечения ожирения, как связанного, так и не связанного с компульсивным перееданием, в силу его способности понижать аппетит (M.Hermanussen, J.Tresguerres, 2005) [27].
Заключение
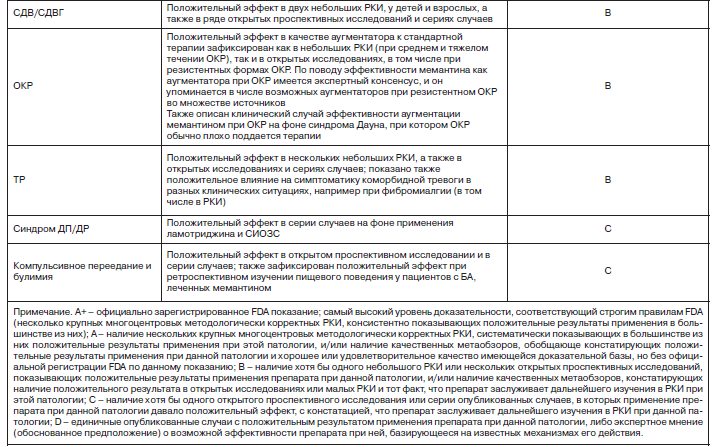
Как видно из приведенных данных, мемантин испытывался в психиатрии почти при всех известных психических патологиях и при многих из них показал положительные результаты применения. Однако надежность имеющейся доказательной базы для его применения при разных психических заболеваниях различна. Чтобы помочь практическому врачу ориентироваться в имеющемся море разнородных по степени доказательности данных о применении мемантина в психиатрии и понять, в каких случаях наиболее вероятно мемантин может оказаться полезным, мы подготовили следующую таблицу.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ГБОУ ВПО СтГМУ. E-mail: yubykov@gmail.com
Список исп. литературы
1. Котов С.В., Исакова Е.В., Чатаева Г.С., Прохорова Н.В. Актинол мемантин в лечении больных ишемическим инсультом. Психиатрия и психофармакотерапия. 2005; 7 (7): 343–5. / Kotov S.V., Isakova E.V., Chataeva G.S., Prokhorova N.V. Aktinol memantin v lechenii bol’nykh ishemicheskim insul’tom. Psyсhiatry and Psychopharmacotherapy. 2005; 7 (7): 343–5. [in Russian]
2. Осадший Ю.Ю., Арчаков Д.С., Тараканова Е.А., Вобленко Р.А. Рандомизированное простое слепое плацебо-контролируемое исследование мемантина как дополнительного средства для лечения негативных симптомов при параноидной шизофрении. Соврем. терапия психических расстройств. 2015; 3: 2–7. / Osadshii Iu.Iu., Archakov D.S., Tarakanova E.A., Voblenko R.A. Randomizirovannoe prostoe slepoe platsebo-kontroliruemoe issledovanie memantina kak dopolnitel’nogo sredstva dlia lecheniia negativnykh simptomov pri paranoidnoi shizofrenii. Sovrem. terapiia psikhicheskikh rasstroistv. 2015; 3: 2–7. [in Russian]
3. Arumugham SS, Reddy JY. Augmentation strategies in obsessive-compulsive disorder. Expert Rev Neurother 2013; 13 (2): 187–202.
4. Bakhla AK, Verma V, Soren S et al. An open-label trial of memantine in treatment-0resistant obsessive-compulsive disorder. Ind Psychiatry J 2013; 22 (2): 149–52.
5. Biederman J, Fried R, Tarko L et al. Memantine in the Treatment of Executive Function Deficits in Adults With ADHD: A Pilot-Randomized Double-Blind Controlled Clinical Trial. J Atten Disord 2014; pii: 1087054714538656.
6. Brennan BP, Roberts JL, Fogarty KV et al. Memantine in the treatment of binge eating disorder: an open-label, prospective trial. Int J Eat Disord 2008; 41 (6): 520–6.
7. Bresink I, Danysz W, Parsons CG et al. Different binding affinities of NMDA receptor channel blockers in various brain regions-indication of NMDA receptor heterogeneity. Neuropharmacology 1995; 34 (5): 533–40.
8. Brown GD, Muzyk AJ, Preud’homme XA. Prolonged Delirium With Catatonia Following Orthotopic Liver Transplant Responsive to Memantine. J Psychiatr Pract 2016; 22 (2): 128–32.
9. Canitano R. New experimental treatments for core social domain in autism spectrum disorders. Front Pediatr 2014; 2: 61.
10. Carpenter SS, Hatchett AD, Fuller MA. Catatonic schizophrenia and the use of memantine. Ann Pharmacother 2006; 40 (2): 344–6.
11. Carrey N, MacMaster F, Sparkes S et al. Glutamatergic changes with treatment in attention deficit hyperactivity disorder: A preliminary case series. J Child Adolesc Psychopharmacol 2002; 12 (4): 331–6.
12. Castle D, Bosanac P, Rossell S. Treating OCD: what to do when first-line therapies fail. Australas Psychiatry 2015; 23 (4): 350–3.
13. Caudron M, Rolland B, Deheul S et al. Catatonia and cannabis withdrawal: A case report. Subst Abus 2016; 37 (1): 188–9.
14. Chez M, Burton Q, Dowling T, et al. Memantine as adjunctive therapy in children diagnosed with autistic spectrum disorders: An observation of initial clinical response and maintenance tolerability. J Child Neurol 2007; 22 (5): 574–9.
15. Cortese BM, Phan KL. The role of glutamate in anxiety and related disorders. CNS Spectrums 2005; 10 (10): 820–30.
16. Cummings JL, Schneider E, Tariot PN et al. Behavioral effects of memantine in Alzheimer disease patients receiving donepezil tre-atment. Neurology 2006; 67 (1): 57–63.
17. Day J, Zienius K, Gehring K et al. Interventions for preventing and ameliorating cognitive deficits in adults treated with cranial irradiation. Cochrane Database Syst Rev 2014; 12: CD011335.
18. De Chiara L, Serra G, Koukopoulos AE et al. Memantine in the treatment and prophylaxis of bipolar type II mood disorder and co-morbid eating disorder: a case report. Riv Psichiatr 2014; 49 (4): 192–4.
19. Erickson C, Posey D, Stigler K et al. A retrospective study of memantine in children and adolescents with pervasive developmental disorders. Psychopharmacology 2007; 191 (1): 141–7.
20. Ferguson JM, Shingleton RN. An open-label, flexible-dose study of memantine in major depressive disorder. Clin Neuropharmacol 2007; 30 (3): 136–44.
21. Feusner JD, Kerwin L, Saxena S et al. Differential efficacy of memantine for obsessive-compulsive disorder vs. generalized anxiety disorder: an open-label trial. Psychopharmacol Bull 2009; 42 (1): 81–93.
22. Ghaleiha A, Asadabadi M, Mohammadi MR et al. Memantine as adjunctive treatment to risperidone in children with autistic disorder: a randomized, double-blind, placebo-controlled trial. Int J Neuropsychopharmacol 2013; 16 (4): 783–9.
23. Ghaleiha A, Entezari N, Modabbernia A et al. Memantine add-on in moderate to severe obsessive-compulsive disorder: randomized double-blind placebo-controlled study. J Psychiatr Res 2013; 47 (2): 175–80.
24. Grant J, Chamberlain S, Odlaug B et al. Memantine shows promise in reducing gambling severity and cognitive inflexibility in pathological gambling: a pilot study. Psychopharmacology 2010; 212 (4): 603–2.
25. Grant JE, Odlaug BL, Schreiber LR, et al. Memantine reduces stealing behavior and impulsivity in kleptomania: a pilot study. Int Clin Psychopharmacol 2013; 28 (2): 106–11.
26. Häge A, Banaschewski T, Buitelaar JK et al. Glutamatergic medication in the treatment of obsessive compulsive disorder (OCD) and autism spectrumdisorder (ASD) – study protocol for a randomised controlled trial. Trials 2016; 17 (1): 141.
27. Hermanussen M, Tresguerres JA. A new anti-obesity drug treatment: first clinical evidence that, antagonising glutamate-gated Ca2+ ion channels with memantine normalises binge-eating disorders. Econ Hum Biol 2005; 3 (2): 329–37.
28. Hong H, Kim BS, Im HI. Pathophysiological Role of Neuroinflammation in Neurodegenerative Diseases and Psychiatric Disorders. Int Neurourol J 2016; 20 (Suppl. 1): S2–7.
29. Huang CY, Wang LC, Shan YS et al. Memantine Attenuates Delayed Vasospasm after Experimental Subarachnoid Hemorrhage via Modulating Endothelial Nitric Oxide Synthase. Int J Mol Sci 2015; 16 (6): 14171–80.
30. Ishikawa I, Shinno H, Ando N et al. The effect of memantine on sleep architecture and psychiatric symptoms in patients with Alzheimer’s disease. Acta Neuropsychiatr 2016; 28 (3): 157–64.
31. Iwamoto K, Ikeda K, Mizumura S et al. Combined treatment of methylprednisolone pulse and memantine hydrochloride prompts recovery from neurological dysfunction and cerebral hypoperfusion in carbon monoxide poisoning: a case report. J Stroke Cerebrovasc Dis 2014; 23 (3): 592–5.
32. Jiang SX, Zheng RY, Zeng JQ et al. Reversible inhibition of intracellular calcium influx through NMDA receptors by imidazoline I(2) receptor antagonists. Eur J Pharmacol 2010; 629 (1–3): 12–9.
33. Joshi G, Wozniak J, Faraone SV et al. A Prospective Open-Label Trial of Memantine Hydrochloride for the Treatment of Social Deficits in Intellectually Capable Adults With Autism Spectrum Disorder. J Clin Psychopharmacol 2016; 36 (3): 262–71.
34. Kishi T, Matsunaga S, Iwata N. Memantine for the treatment of frontotemporal dementia: a meta-analysis. Neuropsychiatr Dis Treat 2015; 11: 2883–5.
35. Koola MM. Kynurenine pathway and cognitive impairments in schizophrenia: Pharmacogenetics of galantamine and memantine. Schizophr Res Cogn 2016; 4: 4–9.
36. Kornhuber J, Weller M, Riederer P. Glutamate receptor antagonists for neuroleptic malignant syndrome and akinetic hyperthermic parkinsonian crisis. J Neural Transm Park Dis Dement Sect 1993; 6 (1): 63–72.
37. Koukopoulos A, Serra G, Koukopoulos AE et al. The sustained mood-stabilizing effect of memantine in the management of treatment resistant bipolar disorders: findings from a 12-month naturalistic trial. J Affect Disord 2012; 136 (1–2): 163–6.
38. Kumar H, Sharma B. Memantine ameliorates autistic behavior, biochemistry & blood brain barrier impairments in rats. Brain Res Bull 2016; 124: 27–39.
39. Lauterbach EC. Repurposing psychiatric medicines to target activated microglia in anxious mild cognitive impairment and early Parkinson’s disease. Am J Neurodegener Dis 2016; 5 (1): 29–51.
40. Laver K, Dyer S, Whitehead C et al. Interventions to delay functional decline in people with dementia: a systematic review of systematic reviews. BMJ Open 2016; 6 (4): e010767.
41. Lee SY, Chen SL, Chang YH et al. Add-on memantine to valproate treatment increased HDL-C in bipolar II disorder. J Psychiatr Res 2013; 47 (10): 1343–8.
42. Lee SY, Chen SL, Chang YH et al. The effects of add-on low-dose memantine on cytokine levels in bipolar II depression: a 12-week double-blind, randomized controlled trial. J Clin Psychopharmacol 2014; 34 (3): 337–43.
43. Lehmann A, Kärrberg L. Effects of N-methyl-D-aspartate receptor antagonists on cisplatin-induced emesis in the ferret. Neuropharmacology 1996; 35 (4): 475–81.
44. Lenze EJ, Skidmore ER, Begley AE et al. Memantine for late-life depression and apathy after a disabling medical event: a 12-week, double-blind placebo-controlled pilot study. Int J Geriatr Psychiatry 2012; 27 (9): 974–80.
45. Matsuda Y, Kishi T, Iwata N. Efficacy and safety of NMDA receptor antagonists augmentation therapy for schizophrenia: an updated meta-analysis of randomized placebo-controlled trials. J Psychiatr Res 2013; 47 (12): 2018–20.
46. Maurice T. Protection by sigma-1 receptor agonists is synergic with donepezil, but not with memantine, in a mouse model of amyloid-induced memory impairments. Behav Brain Res 2016; 296: 270–8.
47. Minkeviciene R, Banerjee P, Tanila H. Cognition-enhancing and anxiolytic effects of memantine. Neuropharmacology 2008; 54 (7): 1079–85.
48. Mohammadi MR, Mohammadzadeh S, Akhondzadeh S. Memantine versus Methylphenidate in Children and Adolescents with Attention Deficit Hyperactivity Disorder: A Double-Blind, Randomized Clinical Trial. Iran J Psychiatry 2015; 10 (2): 106–14.
49. Mori E. How Treatable is Vascular Dementia? [Article in Japanese]. Brain Nerve 2016; 68 (4): 441–50.
50. Muhonen LH, Lahti J, Sinclair D et al. Treatment of alcohol dependence in patients with co-morbid major depressive disorder-predictors for the outcomes with memantine and escitalopram medication. Subst Abuse Treat Prev Policy 2008; 3: 20.
51. Nandhra HS, Murphy CL, Sule A.Novel pharmacological agents targeting memory and cognition in the treatment of anxiety disorders. Hum Psychopharmacol 2013; 28 (6): 538–43.
52. Noruzzadeh R, Modabbernia A, Aghamollaii V et al. Memantine for Prophylactic Treatment of Migraine Without Aura: A Randomized Double-Blind Placebo-Controlled Study. Headache 2016; 56 (1): 95–103.
53. Obregon DF, Velasco RM, Wuerz TP et al. Memantine and catatonia: a case report and literature review. J Psychiatr Pract 2011; 17 (4): 292–9.
54. Olivan-Blázquez B, Herrera-Mercadal P, Puebla-Guedea M et al. Efficacy of memantine in the treatment of fibromyalgia: A double-blind, randomised, controlled trial with 6-month follow-up. Pain 2014; 155 (12): 2517–25.
55. Omranifard V, Rajabi F, Mohammadian-Sichani M. et al. The effect of add-on memantine on global function and quality of life in schizophrenia: A randomized, double-blind, controlled, clinical trial. Adv Biomed Res 2015; 4: 211.
56. Osborne NN, Beale R, Golombiowska-Nikitin K et al. The effect of memantine on various neurobiological processes. Arzneimittelforschung 1982; 32 (10): 1246–55.
57. Ota H, Ogawa S, Ouchi Y et al. Protective effects of NMDA receptor antagonist, memantine, against senescence of PC12 cells: A possible role of nNOS and combined effects with donepezil. Exp Gerontol 2015; 72: 109–16.
58. Owley T, Salt J, Guter S et al. A prospective, open-label trial of memantine in the treatment of cognitive, behavioral, and memory dysfunction in pervasive developmental disorders. J Child Adolesc Psy-chopharmacol 2006; 16 (5): 517–24.
59. Peeters M, Romieu P, Maurice T et al. Involvement of the sigma 1 receptor in the modulation of dopaminergic transmission by amantadine. Eur J Neurosci 2004; 19 (8): 2212–20.
60. Pekrul SR, Fitzgerald KD. Memantine Augmentation in a Down’s Syndrome Adolescent with Treatment – Resistant Obsessive-Compulsive Disorder. J Child Adolesc Psychopharmacol 2015; 25 (7): 593–5.
61. Pickering G, Morel V, Joly D et al. Prevention of post-mastectomy neuropathic pain with memantine: study protocol for a randomized controlled trial. Trials 2014; 15: 331.
62. Pikwer A. Depersonalization disorder may be related to glutamate receptor activation imbalance. Med Hypotheses 2011; 77 (4): 593–4.
63. Ramaswamy S, Madabushi J, Hunziker J et al. An Open-Label Trial of Memantine for Cognitive Impairment in Patients with Posttraumatic Stress Disorder. J Aging Res 2015; 2015: 934162.
64. Rammes G, Rupprecht R, Ferrari U et al. The N-methyl-D-aspartate receptor channel blockers memantine, MRZ 2/579 and other amino-alkyl-cyclohexanes antagonise 5-HT(3) receptor currents in cultured HEK-293 and N1E-115 cell systems in a non-competitive manner. Neurosci Lett 2001; 306 (1–2): 81–4.
65. Rapp A, Dodds A, Walkup JT, Rynn M. Treatment of pediatric anxiety disorders. Ann N Y Acad Sci 2013; 1304: 52–61.
66. Rodriguez CI, Levinson A, Zwerling J et al. Open-Label trial on the effects of memantine in adults with obsessive-compulsive disorder after a single ketamine infusion. J Clin Psychiatry 2016; 77 (5): 688–9.
67. Rogawski MA. What is the rationale for new treatment strategies in Alzheimer’s disease? CNS Spectr 2004; 9 (7 Suppl. 5): 6–12.
68. Rossignol DA, Frye RE. The use of medications approved for Alzheimer’s disease in autism spectrum disorder: a systematic review. Front Pediatr 2014; 2: 87.
69. Schaefer M, Leopold K, Hinzpeter A et al. Memantine-associated reversal of clozapine-induced weight gain. Pharmacopsychiatry 2007; 40 (4): 149–51.
70. Schwartz TL, Siddiqui UA, Raza S. Memantine as an augmentation therapy for anxiety disorders. Case Rep Psychiatry 2012; 2012: 749796.
71. Serra G, De Chiara L, Koukopoulos A et al. Antimanic and long-lasting mood stabilizing effect of memantine in bipolar I mood disorder: two case reports. J Clin Psychopharmacol 2013; 33 (5): 715–7.
72. Serra G, De Chiara L, Koukopoulos AE et al. Memantine in the treatment and prophylaxis of bipolar II disorder and comorbid fibromyalgia: a case report. J Psychiatr Pract 2014; 20 (3): 232–6.
73. Serra G, De Chiara L, Manfredi G et al. Memantine in the management of affective recurrences of bipolar disorders after the discontinuation of long-term lithium treatment: three case histories. Ther Adv Psychopharmacol 2014; 4 (1): 53–5.
74. Serra G, Koukopoulos A, De Chiara L et al. Three-year, naturalistic, mirror-image assessment of adding memantine to the treatment of 30 treatment-resistant patients with bipolar disorder. J Clin Psychiatry 2015; 76 (1): e91–7.
75. Shim SS, Nadeem R. Are NMDA receptor antagonists beneficial in the treatment of schizophrenia? J Psychiatr Res 2014; 51: 19–20.
76. Sierra M. Depersonalization: A New Look at a Neglected Syndrome. 1st Ed. Cambridge Medicine, 2012.
77. Simeon D, Abugel J. Feeling Unreal: Depersonalization Disorder and the Loss of the Self. 1st Ed. Oxford University Press, 2008.
78. Smith EG, Deligiannidis KM, Ulbricht CM et al. Antidepressant augmentation using the N-methyl-D-aspartate antagonist memantine: a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry 2013; 74 (10): 966–73.
79. Smith KL, Rao RR, Velázquez-Sánchez C et al. The uncompetitive N-methyl-D-aspartate antagonist memantine reduces binge-like eating, food-seeking behavior, and compulsive eating: role of the nucleus accumbens shell. Neuropsychopharmacology 2015; 40 (5): 1163–71.
80. Somer E, Amos-Williams T, Stein DJ. Evidence-based treatment for Depersonalisation-derealisation Disorder (DPRD). BMC Psychol 2013; 1 (1): 20.
81. Spilman P, Descamps O, Gorostiza O et al. The multi-functional drug tropisetron binds APP and normalizes cognition in a murine Alzheimer’s model. Brain Res 2014; 1551: 25–44.
82. Stahl SM, Muntner N. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 4th Ed. Cambridge University Press, 2013.
Полный список литературы можно посмотреть на нашем сайте в Интернете: www.con-med.ru
83. Stinton C, McKeith I, Taylor JP et al. Pharmacological Management of Lewy Body Dementia: A Systematic Review and Meta-Analysis. Am J Psychiatry 2015; 172 (8): 731–42.
84. Ströhle A, Schmidt DK, Schultz F et al. Drug and Exercise Treatment of Alzheimer Disease and Mild Cognitive Impairment: A Systematic Review and Meta-Analysis of Effects on Cognition in Randomized Controlled Trials. Am J Geriatr Psychiatry 2015; 23 (12): 1234–49.
85. Strzelecki D, Tabaszewska A, Barszcz Z et al. A 10-week memantine treatment in bipolar depression: a case report. Focus on depressive symptomatology, cognitive parameters and quality of life. Psychiatry Investig 2013; 10 (4): 421–4.
86. Veerman SR, Schulte PF, Smith JD et al. Memantine augmentation in clozapine-refractory schizophrenia: a randomized, double-blind, placebo-controlled crossover study. Psychol Med 2016; p. 1–13.
87. Weller M, Kornhuber J. Pathophysiology and therapy of malignant neuroleptic syndrome. [Article in German]. Nervenarzt 1992; 63 (11): 645–55.
88. Wilkins LK, Girard TA, Cheyne JA. Anomalous bodily-self experiences among recreational ketamine users. Cogn Neuropsychiatry 2012; 17 (5): 415–30.
89. Williams K, Dattilo M, Sabado TN et al. Pharmacology of delta2 glutamate receptors: effects of pentamidine and protons. J Pharmacol Exp Ther 2003; 305 (2): 740–8.
90. Zhao Y, Navia BA, Marra CM et al. Memantine for AIDS dementia complex: open-label report of ACTG 301. HIV Clin Trials 2010; 11 (1): 59–67.
Источник — портал Consilium Medicum: http://con-med.ru